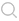【導讀】隨著器官芯片技術(shù)的發(fā)展,其應用仍然存在一定的局限性,大部分生理途徑需要連續(xù)介質(zhì)循環(huán)和組織間相互作用,單器官芯片無法全面反映機體器官功能的復雜性、功能變化和完整性。
隨著器官芯片技術(shù)的發(fā)展,其應用仍然存在一定的局限性,大部分生理途徑需要連續(xù)介質(zhì)循環(huán)和組織間相互作用,單器官芯片無法全面反映機體器官功能的復雜性、功能變化和完整性。為適應人體結(jié)構(gòu)復雜性,未來的研究需要建立更加復雜的多器官微流控芯片(Multi-Organ-Chip, MOC)系統(tǒng),將幾種器官等同物合并到類似人類的代謝環(huán)境中,開發(fā)動態(tài)的實驗室微生物反應器,進行系統(tǒng)的毒性檢測和代謝評估。
微流控芯片技術(shù)(Microfluidics)也被稱為芯片實驗室(Lab-On-a-Chip, LOC),涉及物理、化學、醫(yī)學、流體、電子、材料、機械等多學科交叉的研究領域。通過微通道、反應室和其他某些功能部件,對流體進行精準操控,對生物、化學、醫(yī)學分析過程的樣品制備、反應、分離、檢測等基本操作單元集成分析,具有液體流動可控、集成化、消耗低、通量高、分析快等優(yōu)點,已經(jīng)被廣泛應用于生物醫(yī)學和環(huán)境科學等研究領域。基于微流控芯片技術(shù)的人體器官芯片(Human organs-on-chips)近幾年來發(fā)展迅速,已經(jīng)實現(xiàn)肺、腎、腸、肝、心臟、血管、皮膚、大腦、骨骼、乳腺、脾臟、血腦屏障、氣血屏障等芯片的構(gòu)建,通過與細胞生物學、工程學和生物材料等多種學科的方法相結(jié)合,體外模擬多種活體細胞、組織器官微環(huán)境,反映人體組織器官的主要結(jié)構(gòu)和功能特征。
人體不同器官或整個系統(tǒng)的毒性檢測是藥代動力學和藥效學研究的重要部分,傳統(tǒng)的二維細胞培養(yǎng)模式以及動物實驗取得了諸多成就,但受周期、成本、精準度、倫理等因素的限制,難以預測人體對于各種藥物的響應。研究表明:人體器官芯片技術(shù)能準確地控制多個系統(tǒng)參數(shù),與傳統(tǒng)的毒理學動物實驗相比更能反映人體內(nèi)真實情況,在新藥篩選方面更具特異性。因此,利用微加工技術(shù),建立更接近人體環(huán)境的仿生系統(tǒng)成為體外生理模型的研究熱點。
然而,隨著器官芯片技術(shù)的發(fā)展,其應用仍然存在一定的局限性,大部分生理途徑需要連續(xù)介質(zhì)循環(huán)和組織間相互作用,單器官芯片無法全面反映機體器官功能的復雜性、功能變化和完整性。為適應人體結(jié)構(gòu)復雜性,未來的研究需要建立更加復雜的多器官微流控芯片(Multi-Organ-Chip, MOC)系統(tǒng),將幾種器官等同物合并到類似人類的代謝環(huán)境中,開發(fā)動態(tài)的實驗室微生物反應器,進行系統(tǒng)的毒性檢測和代謝評估。
本文綜述了近年來多器官微流控芯片的研究進展,并對其發(fā)展趨勢進行了展望。
多器官微流控芯片的設計原理
多器官微流控芯片將不同器官和組織的細胞在芯片上培養(yǎng),以微通道相連,實現(xiàn)多器官集成化,以考察其相互作用或建立一個系統(tǒng),用于體外藥物篩選。芯片中可集成數(shù)個經(jīng)過特殊設計的微培養(yǎng)室、灌注通道并同時培養(yǎng)多種細胞,利用微流控技術(shù)可以產(chǎn)生精確可控的流體剪切力、周期性變化的機械力和溶質(zhì)濃度梯度變化的灌注液。利用這些平臺優(yōu)勢,多器官微流控芯片可以用于細致地分析組織、器官特異性應激反應,例如循環(huán)免疫細胞的募集、對藥物、毒素或其他刺激因素的應答等。除此之外,將多個模擬不同器官、組織的芯片,按照體內(nèi)的關系,用血管內(nèi)皮組織、血細胞或是流體介質(zhì)將其連接起來,就能在體外模仿體內(nèi)不同器官、組織之間的生理作用和藥物分布等。
圖1所示為 MOC系統(tǒng)裝置,圖1(a)包括兩個聚碳酸酯蓋板,PDMS-玻璃芯片用于承載血流回路(粉紅色)和排泄流動回路(黃色);數(shù)字分別代表腸道(1),肝臟(2),皮膚(3)和腎臟(4)組織的4個組織培養(yǎng)隔室。多器官芯片布局的頂視圖示出了血液回路中的3個測量點(A,B和 C)的位置以及排泄回路中的兩個測量點(D,E)。該裝置用微泵設備來控制流體的順時針和逆時針流動,以微通道相連接,在芯片上培養(yǎng)構(gòu)建了可容納腸、肝、皮膚、腎4個器官的MOC系統(tǒng),通過兩個流動回路模擬模擬藥物在腸內(nèi)吸收、肝臟代謝以及腎臟排泄,用于體外檢測候選藥物安全性和有效性評估。應用該系統(tǒng)體外模擬了人體內(nèi)葡萄糖代謝的環(huán)境,結(jié)果顯示芯片“口服”藥物,吸收后藥物通過模擬的血液循環(huán),經(jīng)過肝臟,然后進入皮膚和腎臟,到達腎臟器官模型代謝并經(jīng)腎尿液排出,進一步驗證了葡萄糖在小腸內(nèi)的代謝途徑。此外,還有相關研究共培養(yǎng)神經(jīng)球和肝球體,構(gòu)建神經(jīng)系統(tǒng)-肝臟多器官微流控芯片,用2,5-己二酮研究其對組織的毒性作用和代謝途徑,通過測定葡萄糖消耗量和乳酸產(chǎn)量作為MOC系統(tǒng)代謝活動的指標。在肝中,正己烷可能以解毒途徑或者生物活化途徑代謝為己醇,經(jīng)過血液到達大腦產(chǎn)生毒害作用,實驗中對兩種不同濃度的2,5-己二酮的毒性測定結(jié)果表明其誘導了神經(jīng)球和肝微組織中的高度細胞凋亡。
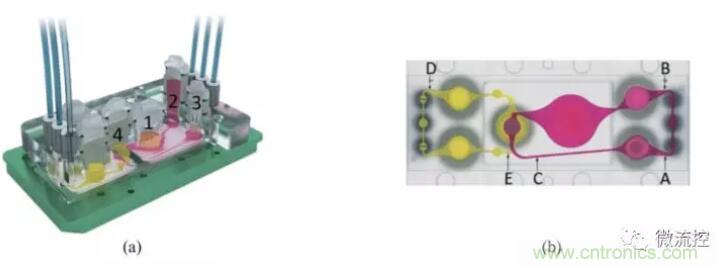
圖1 多器官微流控芯片設計示意圖
多器官微流控芯片系統(tǒng)研究
微細胞培養(yǎng)物類似物(μCCA)與PBPK模型
藥代動力學模型(Physiologically Based Pharmacokinetics, PBPK)是指一種更符合藥物在體內(nèi)動態(tài)變化的具體狀況的模型,對于新藥研發(fā)具有重要作用。PBPK模型以“生理學室”代替經(jīng)典模型中的隔室(房室模型),根據(jù)質(zhì)量平衡關系、按模型建立速度方程、對方程組進行求解、得出各個組織或器官的毒物濃度與時間的關系,可基本明確藥物在體內(nèi)動態(tài)增加或減少的實際情況。由于微流體可以精確控制多個隔室的流動和連接,區(qū)域化的微流體系統(tǒng)可以作為PBPK模型的體外平臺。
經(jīng)過對多器官微流控芯片系統(tǒng)的研究,開發(fā)了一種模擬人類對藥物反應的高通量體外系統(tǒng),將基于微流控芯片的微細胞培養(yǎng)物類似物(Microscale Cell Culture Analog, μCCA)與PBPK模型結(jié)合使用,建立對應PBPK數(shù)學模型的物理裝置(μCCA裝置)。在裝置中,每個器官代表一個隔室,代表關鍵器官的腔室被制造在硅芯片上,并通過微通道相互連接用于模擬血液流動中的介質(zhì)再循環(huán),μCCAs縮小器件可以在體外模擬近生理流體流動條件、體內(nèi)組織的尺寸比以及多組織器官的相互作用,通過使用外部泵和外部常見的介質(zhì)再循環(huán)來支持個體肝臟、骨髓和腫瘤細胞系培養(yǎng)隔室之間的相互作用。在對肝臟、骨髓和腫瘤細胞系共培養(yǎng)研究中,根據(jù)人類組織數(shù)據(jù)設置縮放細胞室及相關參數(shù),μCCA裝置中不同組織或者器官分別以單獨的隔室相連接來模擬多組織器官的作用環(huán)境。實驗結(jié)果顯示,μCCA裝置能夠捕獲肝臟隔室中的代謝,可以觀察到傳統(tǒng)孔板測定中未觀察到的腫瘤細胞的損傷。
結(jié)合PBPK預測的μCCA裝置可以與人體試驗的藥物處理匹配,不僅能模擬動態(tài)的多器官相互作用,并且還能夠模擬現(xiàn)實的生理微環(huán)境,實現(xiàn)體外研究藥物的藥代動力學等藥效學性質(zhì)。μCCA裝置的微環(huán)境是基于一個簡化的PBPK數(shù)學模型設計的,在研究藥代動力學、不同器官細胞間互作及毒性和代謝相互作用的假設檢驗等方面有重要意義。不足的是,當細胞以流體連接的方式培養(yǎng)時,培養(yǎng)基在提供營養(yǎng)物質(zhì)、去除細胞廢物的同時,也可能會放大未知灌注液對隔室細胞的毒性作用。
多通道三維微流控細胞培養(yǎng)系統(tǒng)(3D-μFCCS)
由于μCCA裝置的不足,要設計一個體內(nèi)高度保守的系統(tǒng),重要的是以流體聯(lián)系的方式培養(yǎng)多種細胞類型,同時保持彼此間的隔離,據(jù)此開發(fā)了一種多通道3D微流控細胞培養(yǎng)系統(tǒng)(3D microfluidic Cell Culture System, 3D-μFCCS)。
3D-μFCCS是由多個微通道相互連接的微流體通道和微陣列組成,采用微陣列技術(shù)對多種細胞類型進行高密度物理固定,以獲得最大的細胞-細胞相互作用。在3D球形微組織和微流控技術(shù)進行多組織實驗分析中,將預先形成的球形微組織裝載到微室中并在連續(xù)灌注下培養(yǎng),通過自動化的芯片傾斜由重力驅(qū)動的流動產(chǎn)生,而不需要額外的管道和外部泵。以3D-μFCCS為基礎構(gòu)建的鼠肝和大腸腫瘤MOC系統(tǒng)在前體藥物環(huán)磷酰胺存在下培養(yǎng)8d,僅在芯片上不同微量組織類型的共培養(yǎng)物中觀察到對腫瘤生長有顯著影響,而環(huán)磷酰胺處理的靜態(tài)肝臟微組織的不連續(xù)轉(zhuǎn)移上清液并不顯著影響腫瘤生長。該系統(tǒng)驗證了環(huán)磷酰胺對腫瘤生長有顯著的影響,但在體外無抗腫瘤活性,只有在肝臟被生物活化之后才起作用。
此外,多通道3D-μFCCS還被設計用于同時培養(yǎng)不同器官的細胞聚集體以模擬身體中的多個器官。培養(yǎng)4種不同的細胞類型,以模擬人類的4種器官:C3A(肝臟),A549(肺臟),HK-2(腎臟)和 HPA(脂肪),通過補充常見的培養(yǎng)基與生長因子來優(yōu)化細胞功能。在細胞培養(yǎng)過程中,特異性地將TGF-β1在A549室內(nèi)控制釋放,能增強A549細胞的功能,而C3A、HK-2和HPA細胞的功能不受影響,與模擬單個組織功能有所不同。3D-μFCCS裝置上,細胞培養(yǎng)隔室之間有限的相互作用類似于體內(nèi)的情況。
單向流動的生物測定系統(tǒng)及其他MOC系統(tǒng)
相比μCCA和3D-μFCCS,Imura及其同事構(gòu)建的生物測定系統(tǒng)是相對先進的版本,它將人類的腸道,肝臟和乳腺癌細胞系培養(yǎng)物組合成一個單一的線性通道,應用單向流動而不需要介質(zhì)再循環(huán)。微芯片由載玻片,透氣膜和聚二甲基硅氧烷片組成,其中含有通過光刻制成的微通道。將Caco-2克隆結(jié)腸腺癌細胞在微芯片的膜上培養(yǎng),模擬藥物的體內(nèi)腸轉(zhuǎn)運:環(huán)磷酰胺能透過腸屏障的,表現(xiàn)出較高的滲透系數(shù),環(huán)磷酰胺不能被腸壁吸收的,表現(xiàn)出較低的滲透系數(shù)。滲透測試結(jié)果與使用傳統(tǒng)方法獲得的結(jié)果一致,而電池消耗減少80%。
近年來,在原有器官芯片系統(tǒng)的基礎上,MOC系統(tǒng)進一步發(fā)展完善。Loskill等利用μOrgano系統(tǒng)研究多個心臟單元,可以單獨加載不同類型的細胞,控制分化和發(fā)育的時間,控制各個組織的流體連接,即插即用。Maschmeyer等設計了可容納兩個微生物流體流動回路的MOC裝置,首次實現(xiàn)了腸、肝、皮膚和腎4個器官組織在微流控芯片上重復培養(yǎng)28d,且所有組織在整個共培養(yǎng)期間保持高細胞活力和離散的生理組織結(jié)構(gòu),成功從生理角度證明了腸道的功能以及腎臟的生物屏障。除了腸屏障與腎屏障,多器官微流控芯片還成功地模擬了人體的多個生物屏障,例如利用Transwell裝置在懸浮于孔中的濾膜上培養(yǎng)細胞模擬血腦屏障進行藥物轉(zhuǎn)運研究及檢測特定標志物的表達,在氣液界面實現(xiàn)肺上皮細胞與血管內(nèi)皮細胞共培養(yǎng)的氣血屏障等。
多器官微流控芯片的設計及新應用
多器官微流控芯片設計
多器官微流控芯片的設計基于PBPK的理念,可利用模型預測人體對藥物的反應以及藥物的作用機制。最常制造的裝置是尺寸在10~200mm之間的微流體通道,隔室的大小根據(jù)其功能正確地設計比例,不同的器官功能根據(jù)其機制的不同而具有不同的尺度。微流體系統(tǒng)材料通常采用聚二甲基硅氧烷,優(yōu)化后多用多孔性較好的水凝膠,可允許水凝膠支架內(nèi)的分子擴散。芯片制作后需要鑒定和測量培養(yǎng)的組織在用藥物或工程刺激物處理時的功能反應,進行細胞活力、機械力、電信號檢測以及化學分析等。
目前,設計微流控芯片體系主要使用PBPK模型和PD模型。在PBPK模型中,藥代動力學 (Pharmacokinetics, PK)建模的方法用來設計和操作以再現(xiàn)多器官相互作用。PK建??闪炕眢w不同部位的藥物量,可用簡單的術(shù)語來描述藥物給藥后吸收、分布、代謝和消除的復雜過程,并深入了解藥物分布動力學。然而,建立一個生理學上準確的模型是十分困難的,因此限制了PK建模的廣泛使用。藥效動力學(Pharmacodynamics, PD)建模中藥理學作用被視為藥物濃度的函數(shù),是針對藥物在體內(nèi)的藥理作用的研究模型。單獨的PK模型不能闡明時間-藥效的關系,單獨的PD模型也不能闡明時間-濃度的關系,因此需要結(jié)合兩者建立PK-PD模型以研究藥物作用靶部位的濃度-效應-時間三維關系。在PBPK-PD模型中,PD模型與PK 模型耦合,使用組合的PK-PD模型來預測或分析給定劑量藥物的生理效應,綜合PK-PD模型可以評估特定劑量下藥物的生理結(jié)果的時間依賴性變化,應用性相對較廣泛。
多器官微流控芯片的新應用
隨著多器官微流控芯片在藥物代謝方面應用研究的深入,也產(chǎn)生了各種新應用,如利用肺器官芯片研究納米材料毒性及代謝。哈佛大學通過研究肺對熒光納米顆粒傳遞至肺上皮細胞引發(fā)的一系列毒性反應,來探究應用于環(huán)境毒理學的肺芯片系統(tǒng)的潛在價值,為環(huán)境污染物的體內(nèi)代謝模擬研究開拓了新的視野。
與大氣污染物有關的癌癥病例中,細顆粒物PM2.5起至關重要的作用,PM2.5可以穿透人體肺屏障并進入血液系統(tǒng)引發(fā)各種疾病甚至癌癥。但其在體內(nèi)的代謝途徑和致癌作用機理尚不明確。而目前研發(fā)的應用于藥代動力學和藥效學方面的多器官微流控芯片系統(tǒng)為該類研究提供了新的技術(shù)上的可能。為研究大氣污染與疾病發(fā)生,目前研發(fā)的肺上芯片系統(tǒng)已經(jīng)能夠測試空氣中的微粒和物質(zhì)對單層細胞或三維細胞聚集體的毒性?;谖⒘骺丶夹g(shù)評估空氣質(zhì)量對人類健康的影響,利用器官芯片模擬健康和病態(tài)肺的功能,對空氣傳播的污染物暴露對呼吸系統(tǒng)的短期和長期影響進行無動物測試。與口服藥的代謝途徑不同,顆粒物在體內(nèi)的代謝途徑主要有兩種:一是經(jīng)皮膚入血,經(jīng)由心入肺再進入體循環(huán)分配到肝和腎;二是經(jīng)肺泡入血進入體循環(huán)分配到肝和腎。而未知濃度的真實大氣顆粒物樣品進入體內(nèi)的分布和代謝由于難以監(jiān)測,無法確定其濃度,因此缺乏相應的數(shù)學模型來進行后續(xù)的研究和預測,目前多是采用熒光標記的人造顆粒物來進行模擬。因此在肺芯片相關毒性研究的基礎上,設計合理的真實反應顆粒物體內(nèi)代謝的多器官微流控芯片系統(tǒng),建立完整的模擬顆粒物代謝的體外平臺、精準確定顆粒物代謝途徑、制定精確的代謝模型并進一步揭示顆粒物的致癌機理是亟待進一步深入研究的重要科學問題。
此外,微芯片制造通過微電子機械系統(tǒng)(Microelectromechanical systems, MSMS)與芯片實驗室和器官微流控芯片系統(tǒng)相結(jié)合,MEMS允許將幾種微小或納米微傳感器、致動器、加速度計、熱控制器、微流體推進器、微波設備、衛(wèi)星通信等的各種組件最小化,可用于衛(wèi)星等航天技術(shù),也可用于監(jiān)測沙塵暴或火山活動等產(chǎn)生的污染源。
展望
微流控技術(shù)由微加工技術(shù)與三維培養(yǎng)相結(jié)合產(chǎn)生,在體外細胞培養(yǎng)中潛力較高。多器官微流控芯片技術(shù)可在微尺度對流體精準控制,模擬人體生理環(huán)境,克服了傳統(tǒng)二維細胞培養(yǎng)模式與動物實驗的不足,具有高度仿生性。MOC系統(tǒng)的發(fā)展結(jié)合了工程技術(shù)的優(yōu)點,可調(diào)整流體流動和微通道中可控的局部組織-流體比率。MOC技術(shù)旨在建立人工的仿生環(huán)境,在器官-組織水平上模擬,以研究不同器官細胞之間的相互作用、相關生理代謝途徑以及生理毒性檢測等。
人體芯片(Human-on-a-chip)是一種利用微加工技術(shù),基于MOC系統(tǒng)將多個器官微流控芯片連用反映人體整體系統(tǒng)的仿真體系。自2011年NIH、FDA和國防部人體芯片專項設立以來,全世界范圍內(nèi)掀起了人體芯片的研究熱潮。Human-on-a-chip旨在通過動態(tài)控制細胞微環(huán)境的各種培養(yǎng)條件,在微流控芯片上模擬人類多個器官主要功能,從而達到復原芯片上的“人體”系統(tǒng)。相較于單器官芯片,人體芯片更能全面反映機體器官功能的復雜性、功能變化和完整性,并且應用性更強。
目前,基于MOC系統(tǒng)的發(fā)展和完善,已經(jīng)實現(xiàn)了體外模擬心臟、生物血管、肺癌細胞轉(zhuǎn)移、 腸道功能和腎臟生物屏障等環(huán)境。雖然MOC克服了傳統(tǒng)二維細胞和動物實驗的諸多不足,但是也面臨芯片設計上器官的縮放、高通量分析、芯片上的檢測分析、疾病模型和細胞來源等問題,在實驗中涉及到的長期的動態(tài)營養(yǎng)平衡、器官的細胞和組織穩(wěn)態(tài)、毒性檢測的完整性、檢測方法的特異性和靈敏度、芯片的材料等依舊是MOC系統(tǒng)亟待解決和完善的。此外,MOC在生物學研究、醫(yī)學、毒性測試、藥物代謝等領域應用比較多,但在進入體內(nèi)的污染物比如顆粒物PM2.5對人體的毒害及體內(nèi)代謝方面研究極少。相信隨著技術(shù)的發(fā)展和研究的深入,MOC系統(tǒng)將廣泛應用于醫(yī)學、藥學、生命科學等領域,我們離‘Human-on-a-chip’的實現(xiàn)亦越來越近。